Il processo di delocalizzazione elettronica degli idrocarburi
In chimica fisica l’elettrone delocalizzato è una molecola non associata ad un atomo o ad un legame covalente e che fa parte di un sistema elettronico che si estende agli atomi adiacenti. In questo modo prendono vita sistemi coniugati con doppi legami e sistemi aromatici.
Lo stesso processo di delocalizzazione elettronica avviene nei metalli solidi dove l’orbitale d interferisce con l’orbitale s superiore. In questo caso esistono i cationi e ioni positivi che si allineano in un mare di elettroni, che sono liberi di muoversi nella struttura. Questo permette al metallo di sviluppare determinate caratteristiche come la conduttività elettrica.
La delocalizzazione elettronica del benzene
Il benzene si compone per un semplice anello aromatico in cui le distanze di legame sono tutte uguali C-C. Oltre al benzene si annoverano tra gli elettroni delocalizzati gli acidi carbossilici, che sciolti in acqua portano alla dissociazione del protone e degli elettroni che si delocalizzano in due atomi di ossigeno.
Gli elettroni delocalizzati sono importanti per molte ragioni. La reazione chimica potrebbe non avvenire perché gli elettroni delocalizzano in configurazione stabile, ad esempio tentando un'alchilazione di Friedel-Crafts del benzene con 1cloro-2metilpropano, il carbocatione riarrangia ad un gruppo ter-butile stabilizzato da iperconiugazione, un particolare tipo di delocalizzazione.
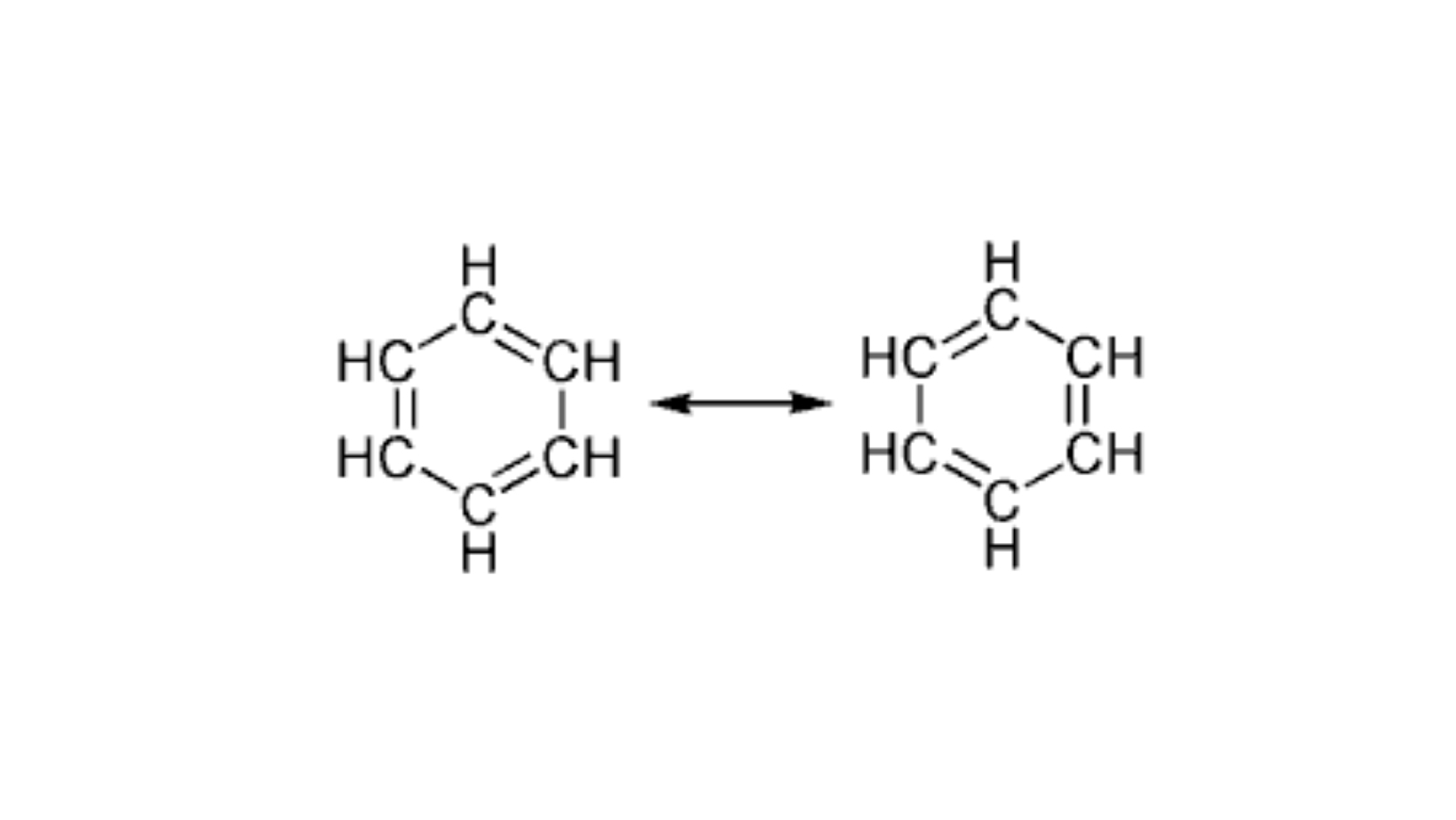
Tra gli idrocarburi aromatici, così chiamati per il loro odore pungente e caratteristico, il benzene è quello che è maggiormente insaturo e ha una formula di struttura C6H6 davvero particolare. Gli atomi di carbonio della catena del benzene sono ibridati sp2 e si uniscono tra di loro e all’idrogeno grazie a dei legami \sigmaσ. I sei elettroni rimasti sovrappongono i propri orbitali p a formare un’unica nube elettronica distribuita sull’intera molecola. Il risultato è un legame \piπ molto stabile in cui gli elettroni sono condivisi tra tutti gli atomi di carbonio, situazione che prende il nome di delocalizzazione elettronica.
Quali idrocarburi hanno la delocalizzazione elettronica
Il più conosciuto degli idrocarburi aromatici è proprio il benzene che, come abbiamo visto, passa da una formula chimica all’altra secondo la delocalizzazione elettronica.
In chimica si parla di elettroni delocalizzati e elettroni localizzati, che sono quelli che appartengono ad un singolo atomo e quelli che si trovano all'interno di un legame tra due atomi. I primi, invece, sono condivisi tra più atomi.
Le condizioni che permettono la delocalizzazione elettronica sono: presenza di un orbitale P che si sovrapponga agli orbitali P degli atomi adiacenti; presenza sullo stesso piano di tutti gli atomi che condividono gli elettroni. Rientrano in queste condizioni i composti aromatici come il benzene, piridina, sistemi alfa- beta insaturi come l'acroleina.
Quando analizziamo una molecola con delocalizzazione elettronica non possiamo disegnare gli elettroni in un unico legame perchè questi sono delocalizzati nell'intera struttura, perciò i chimici scrivono delle strutture con elettroni localizzati che sono strutture limite di risonanza che contribuiscono alla reale struttura elettronica della molecola.
Se vuoi saperne di più sulla delocalizzazione elettronica degli idrocarburi puoi contattare gli specialisti di Settala Gas, che dal 1966 produce, distribuisce e commercializza idrocarburi per diversi usi industriali. Contattaci per maggiori informazioni!




